'Oppløsnings revolusjon', Intelligent design, nå på atomnivå
David Coppedge; Oversatt herfra.
 Aldri si aldri, fordi mennesker er flinke. Fysikklærere pleide å si at mennesker aldri vil kunne se atomer gjennom noe mikroskop på grunn av en grunnleggende barriere for oppløsning kalt diffraksjonsgrensen. Men i likhet med fireminuttersmila og lydmuren, ble denne rekorden laget for å slås. I dag gjør optiske ingeniører det. Individuelle atomer kommer i fokus!
Aldri si aldri, fordi mennesker er flinke. Fysikklærere pleide å si at mennesker aldri vil kunne se atomer gjennom noe mikroskop på grunn av en grunnleggende barriere for oppløsning kalt diffraksjonsgrensen. Men i likhet med fireminuttersmila og lydmuren, ble denne rekorden laget for å slås. I dag gjør optiske ingeniører det. Individuelle atomer kommer i fokus!
En gjennomgang publisert i 2015 i Methods in Molecular Biology -lenke, forklarte hvordan diffraksjonsgrensen ble brutt:
Bilde 1. Atom fotografert gjennom kryo-elektronmikroskop
-Konvensjonelle mikroskopiteknikker, nemlig det konfokale mikroskopet eller dekonvolusjonsprosessene, er oppløsningsbegrenset, ~250 nm, av lysets diffraksjonsegenskaper som utviklet av Ernst Abbe i 1873. Denne diffraksjonsgrensen er betydelig over størrelsen til de fleste multiproteinkomplekser, som er typisk 20–50 nm i diameter. På midten av 2000-tallets første tiår beveget biofysikere seg utover diffraksjonsbarrieren ved å strukturere belysningsmønsteret og deretter bruke matematiske prinsipper og algoritmer for å tillate en oppløsning på omtrent 100 nm, tilstrekkelig til å løse protein subcellulære koloniseringsspørsmål. Dette "bruddet" av diffraksjonsbarrieren, som gir oppløsning mindre enn 200 nm, kalles superoppløsningsmikroskopi. Nyere tilnærminger inkluderer enkeltmolekyllokalisering (som PhotoActivated Localization Microscopy (PALM)/STochastic Optical Reconstruction Microscopy (STORM)) og punktsprednings-funksjonsteknikk (som STimulated Emission Depletion (STED) mikroskopi).
Superoppløsningsmikroskopi har eksplodert siden diffraksjonsgrensen ble overskredet. I stedet for 100 nm, avbilder forskere objekter på 10 nm og mindre. Hvert nytt artikkel presser grensen: ned til 5nm, 4nm, 3nm, hvor individuelle domener av molekylære maskiner kan sees.
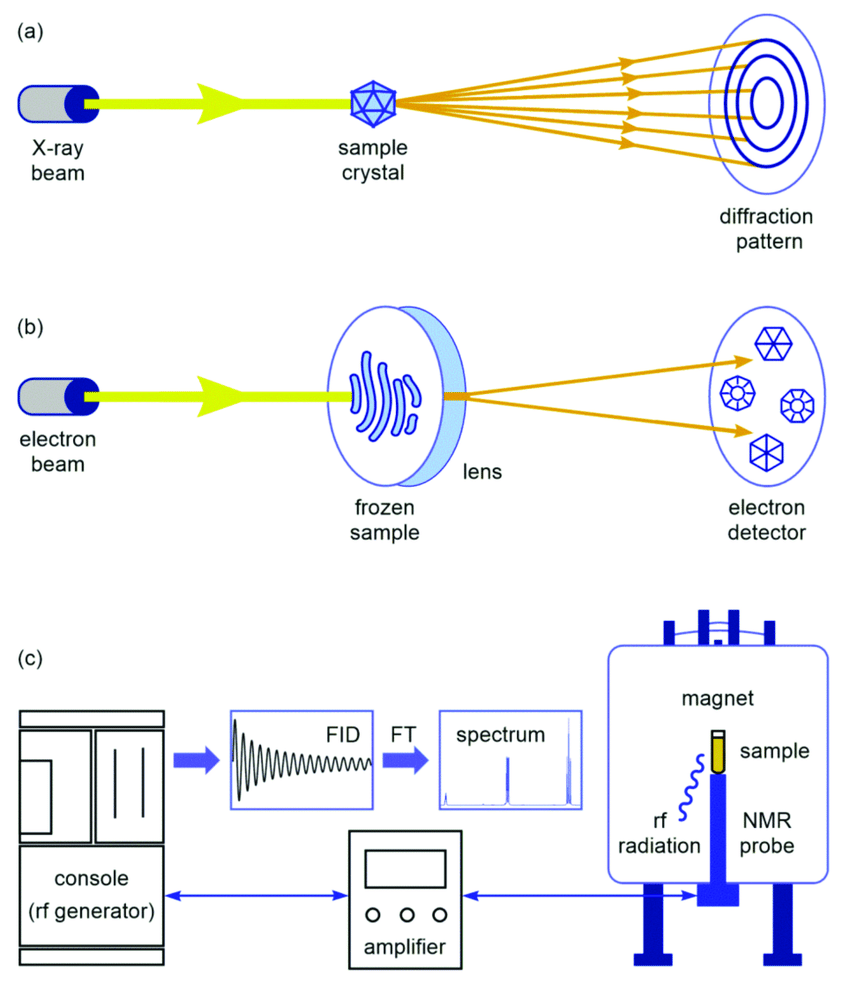 Kryo-elektronmikroskopi
Kryo-elektronmikroskopi
Disse suksessene skyldes i stor grad introduksjonen av kryo-elektronmikroskopi (se artikkel i Protein Science -her), som sjokkfryser prøven for å stabilisere den før den avbildes i et elektronmikroskop. Teknikken ga tre biofysikere Nobelprisen i kjemi i 2017. Cryo-EM ble unnfanget på slutten av 1990-tallet, og ble mainstream rundt 2013 og er nå toppmoderne. Likevel hadde cryo-EM sin egen oppløsningsbarriere.
I oktober kunngjorde Max Planck Institute en ny verdensrekord for cryo-EM av Holger Stark som brøt gjennom barrieren. "For første gang lyktes gruppen hans i å observere individuelle atomer i en proteinstruktur og ta de skarpeste bildene noensinne med denne metoden." Nå vil forskerne ikke lenger måle i nanometer, men i Ångstrøm-enheter - en størrelsesorden mindre.
-Ved hjelp av det nye mikroskopet har forskerne tatt mer enn én million bilder av proteinet apoferritin for å kartlegge molekylstrukturen med en oppløsning på 1,25 ångstrøm. En ångstrøm tilsvarer en ti milliondels millimeter. "Vi visualiserer nå enkeltatomer i proteinet - en milepæl innen vårt felt," forklarer strukturbiolog Stark. «For oss var det som å sette superbriller på mikroskopet. Den nye strukturen avslører detaljer som aldri er sett før: Vi kan til og med se tettheten for hydrogenatomer og enkeltatoms kjemiske modifikasjoner."
Nature News and Views kommenterer at "Denne enestående bragden ville ikke blitt antatt gjennomførbar for bare et tiår siden." Teknikken som brukes av Starks team (publisert i samme utgave av Nature av Yip et al.) kalles "single particle cryo-EM." Det er en del av en "oppløsningsrevolusjon" som begynte i 2013. Starks team avbildet et ferritinmolekyl, en benchmark for cryo-EM på grunn av dets stabilitet og symmetri, men en følgeseddel i Nature av Nakane et al. beskriver deres suksess med å avbilde en del av et mer bevegelig proteinkompleks med en oppløsning på 1,7 ångstrøm. Dette nærmer seg lengden av en karbon-karbonbinding (1,5 ångstrøm, ifølge Phys.org).
Bilde 2. Prinsipp ved kryo-elektromiskopi (b)
Utviklingen innen cryo-EM-maskinvare beskrevet av Yip, Nakane og deres respektive kolleger har drevet et stort fremskritt i oppløsningen av enkeltpartikkel-kryo-EM. Hvert team brukte maskinvare som taklet distinkte aspekter ved cryo-EM-avbildning som tidligere hadde begrenset oppløsningen som var oppnåelig. Med disse teknologiene vil det økte signal-til-støy-forholdet til cryo-EM-bilder utvide teknikkens anvendelighet. For eksempel kan dette inkludere å bruke teknikken for å bestemme høyoppløselige strukturer av heterogene prøver lik de som er dannet av membranproteiner, eller makromolekylære komplekser, som varierer i konformasjon eller sammensetning. Kanskje sammensmeltingen av disse teknologiene vil muliggjøre bestemmelse av kryo-EM-strukturer med en oppløsning utover til og med 1 Å. Dette kan en gang ha virket som et nesten umulig oppdrag å ta fatt på.
Flere bildefremskritt
Adaptiv optikk har lenge vært brukt av astronomer for å gjøre bilder av stjerner skarpere ved å redusere utsmøringen forårsaket av turbulens i atmosfæren. Teknikken bruker en laserstråle som en guide, og forskyver teleskopets speil raskt for å holde referansestrålen stødig. Kan den teknikken brukes i den andre enden av røret - det vil si i et mikroskop? Ja! Et team ledet av Daniel Hammer fra Food and Drug Administration (FDA) var i stand til å avbilde små mikroglia i den indre begrensende membranen til den menneskelige netthinnen ved hjelp av adaptiv optikk (AO). Ved å kombinere dette med optisk koherenstomografi (OCT), som tillater optisk dybdeseksjonering av bilder for en 3-D-visning, var de i stand til å følge disse mikrogliaene, "de første som reagerer på nevrale skader", i sanntid i levende mennesker. Det er bare en av mange mulige anvendelser av denne metoden, sier de; "Evnen til å visualisere makrofagceller uten fluorescerende merking i det levende menneskelige øyet representerer et viktig fremskritt for både oftalmologi og nevrovitenskap, noe som kan føre til nye sykdomsbiomarkører og nye veier for utforskning av sykdomsprogresjon." Resultatene ble publisert forrige måned i PNAS -lenke.
Mer om superoppløsningsavbildning kan finnes i Journal of the American Chemical Society: "Superoppløsningsmikroskopi med enkeltmolekyler i biologi og utover - Essentials, Current Trends, and Future Challenges." Forfatterne Leonhard Möckl og W. E. Moerner fra Stanford sier: "Til tross for den enorme fremgangen, er det fulle potensialet til enkeltmolekyls super-oppløsningsmikroskopi ennå ikke realisert, noe som vil bli muliggjort av forskningen foran oss."
Bilde 3. 3D-bilder i praktisk tannlegebruk
 Multifocus 3-D Imaging tok et sprang med en ny teknikk som Phys.org kaller en "enkel måte å fange høykvalitets 3D-bilder av levende celler og organismer." Et team ledet av Sheng Xiao fra Boston University brukte et z-splitterprisme for å dele lysstråler fra prøven i "flere bilder, hver fokusert til en annen dybde i prøven, i en enkelt kameraramme." I stedet for et flatt bilde i ett fokalplan, gir denne teknikken 3D-bilder fra standard optiske mikroskoper. "Vi brukte et z-splitterprisme som kan settes helt sammen fra hyllekomponenter og som enkelt kan brukes på en rekke avbildningsmodaliteter som fluorescens, fasekontrast eller mørkfeltsavbildning," sa Xiao. Det kan "bare legges til de fleste eksisterende systemer og er enkelt å replikere, noe som gjør det tilgjengelig for andre forskere." Teknikken deres er beskrevet i tidsskriftet Optica.
Multifocus 3-D Imaging tok et sprang med en ny teknikk som Phys.org kaller en "enkel måte å fange høykvalitets 3D-bilder av levende celler og organismer." Et team ledet av Sheng Xiao fra Boston University brukte et z-splitterprisme for å dele lysstråler fra prøven i "flere bilder, hver fokusert til en annen dybde i prøven, i en enkelt kameraramme." I stedet for et flatt bilde i ett fokalplan, gir denne teknikken 3D-bilder fra standard optiske mikroskoper. "Vi brukte et z-splitterprisme som kan settes helt sammen fra hyllekomponenter og som enkelt kan brukes på en rekke avbildningsmodaliteter som fluorescens, fasekontrast eller mørkfeltsavbildning," sa Xiao. Det kan "bare legges til de fleste eksisterende systemer og er enkelt å replikere, noe som gjør det tilgjengelig for andre forskere." Teknikken deres er beskrevet i tidsskriftet Optica.
Flotte verktøy for ID
Unødig å si, vil disse fremskrittene innen bildebehandling være en velsignelse for designvitenskap. I stedet for å være begrenset til det tåkete bildet av den bakterielle flagellen tilgjengelig for Michael Behe i 1996, kan forskere nå se i detalj på individuelle molekyler som utgjør maskinen. Mange journalartikler beskriver allerede flere ikoniske molekylære maskiner i enestående detalj. Her er noen nyere eksempler:
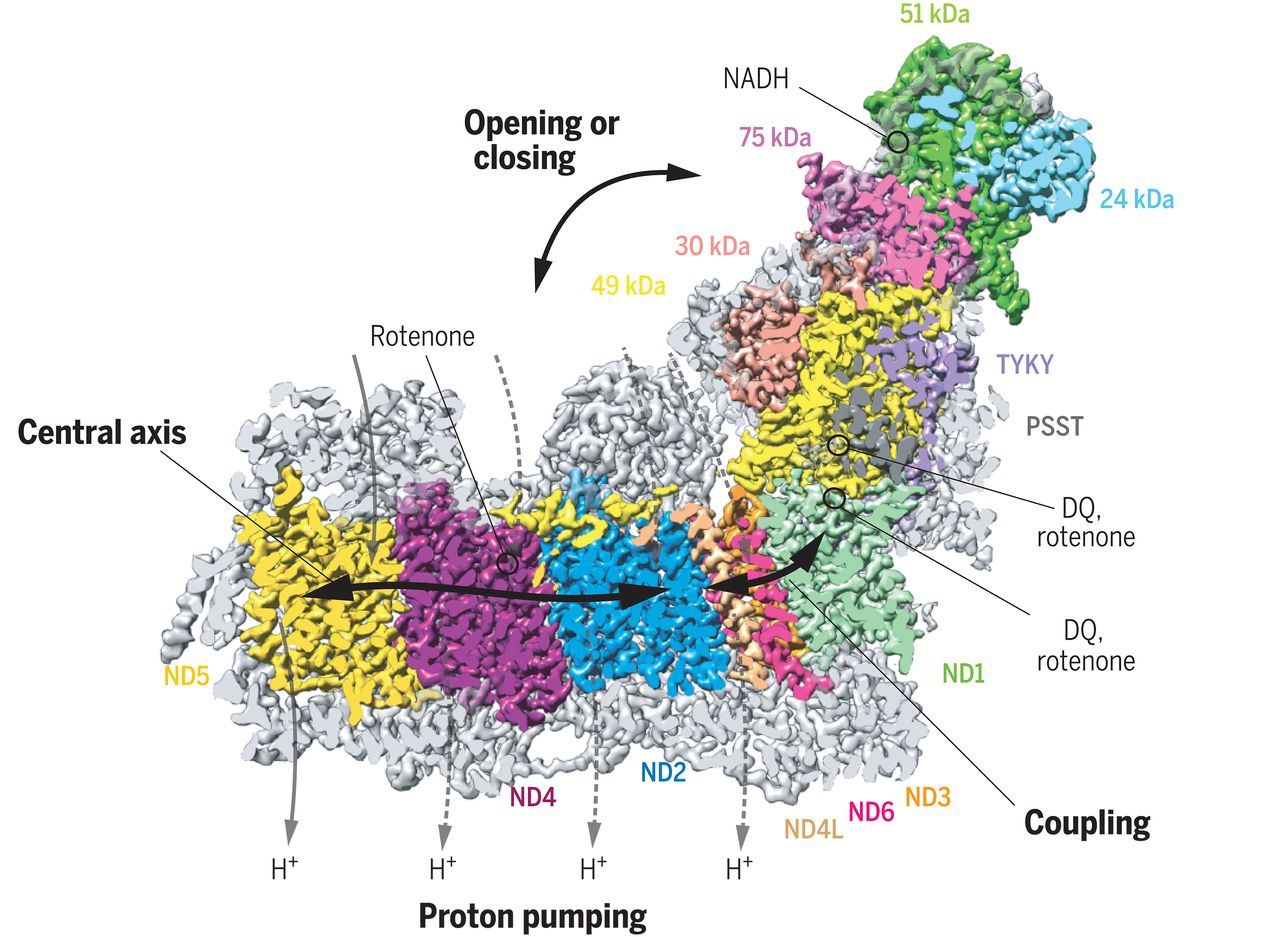
Mitokondrier. Østerrikske forskere løste koblingsmekanismen i pattedyrets respiratoriske kompleks I (den første maskinen i mitokondriets elektrontransportkjede) ved 2,3 ångstrøm (Kampjut og Sazanov, Science). "Oppløsningen til noen strukturer var tilstrekkelig til å se vannmolekyler og spore antatte baner for protonoverføring innenfor det protonpumpende membrandomenet," heter det i et sammendrag. "Strukturene legger til verdifulle detaljer som gir grunnlag for å generere mekanistiske hypoteser for dette avgjørende komplekset." Visuelle bevis på cryo-EMs verdi kan sees i to filmer de laget, tilgjengelig i tilleggsmaterialet.
Bilde 4. Mitokondrie -kompleks 1
Ribosomet. Hvordan molekylære maskiner settes sammen er av stor interesse for designvitenskap. Ribosomet, som oversetter mRNA til protein, består av en liten 40S underenhet og en stor 60S underenhet. Disse kommer sammen til en fungerende maskin ved hjelp av 200 faktorer på "en svært koordinert måte", sier Michael Ameismeyer et al. i Nature -lenke. Ved å bruke cryo-EM var teamet i stand til å finne ut det "strukturelle grunnlaget for de siste trinnene i menneskelig 40S-ribosommodning."
ATP-syntase. Et annet favoritt-ID-ikon har blitt avbildet med cryo-EM i nok detaljer til å se hvordan den perifere stilken er satt sammen. Teamet til Jiulia He inkluderte nobelpris-vinneren John E. Walker og har blitt publisert i PNAS. Montering av human ATP-syntase krever 27 kjernekodede proteiner og to andre kodet i mitokondriene. Superoppløsningsmikroskopi lar nå forskere se "hvordan komponenter i den perifere stilken og tre tilknyttede membranunderenheter settes sammen og introduseres i enzymkomplekset." En annen artikkel i Nature Structural & Molecular Biology avslører "Cryo-EM-strukturen til hele pattedyrs F-type ATP-syntase."
P22-sammensetning -lenke.
Bakteriell flagell. Hvordan kunne vi unngå nevne den molekylære maskinen som åpnet øynene til mange, for intelligent design? Nye resultater ved bruk av cryo-EM-teknologi avslører detaljer om flagellen som Chang et al., i Nature Structural & Molecular Biology, brukte cryo-EM for å foreslå en "molekylær mekanisme for rotasjonssvitsjing av den bakterielle flagellmotoren." I teamets overraskende modell settes rotoren i bevegelse av andre rotorer! En ring av MotA-underenheter snur rotoren som et sett med gir, og kan raskt bytte til å snu den andre veien.
Bakterie-flagellen: herfra.
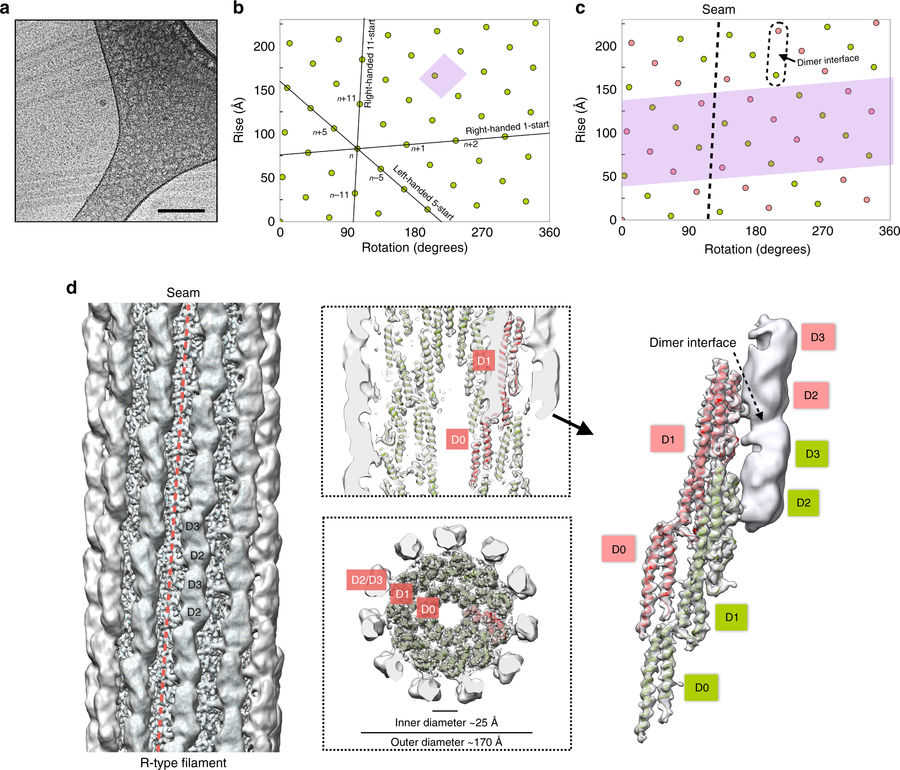 I en kommentar til denne modellen i Nature Structural & Molecular Biology, beskrev Keiichi Namba den som et "to-tannhjul"-arrangement. Dette kan forklare hvordan rotoren kan bytte retning i en kvart omdreining, som Jed Macosco har sagt -hefra. Namba sier,
I en kommentar til denne modellen i Nature Structural & Molecular Biology, beskrev Keiichi Namba den som et "to-tannhjul"-arrangement. Dette kan forklare hvordan rotoren kan bytte retning i en kvart omdreining, som Jed Macosco har sagt -hefra. Namba sier,
-CW-rotasjonen til MotACD kan generere dreiemomentet for C-ringrotasjon i enten CCW- eller CW-retninger gjennom forskjellige interaksjonsmoduser med FliG på toppen av C-ringen, det vil si enten med innsiden av røret (nærmere motoraksen) eller med motsatt ytre side... Dette er akkurat som et girsystem med to tannhjul, sammensatt av små og store tannhjul, med tannhjul ved sylinderkantene som kan bytte deres relative posisjoner; det lille tannhjulet (MotA) genererer alltid dreiemoment i én retning, men det kan gripe inn i det store tannhjulet (FliG i C-ringen) via enten dets indre eller ytre kanter, og dermed drive rotasjon av det store tannhjulet i begge retninger.
Disse nye høyoppløselige bildene bør være øyegodteri for Behe og alle andre ID-tilhengere. Se for deg å kikke under panseret på denne maskinen og observere rotoren og statoren til denne motoren med høy oppløsning. Namba var tydelig imponert og sa at flagellen opererer med "nesten 100 % effektivitet" og har blitt målt med en maksimal hastighet på "1700 omdreininger per sekund" (102.000 rpm), "som er mye raskere enn for en Formel 1-racerbil motor."
Bilde 5. Bilde av flagellar filament
Jo nærmere du ser
Superoppløsningsmikroskopi vil absolutt være en velsignelse for designvitenskap. ID-forkjempere har ofte påpekt at jo nærmere man ser på biologiske systemer, jo mer konstruert ser de ut. Foreløpig krever toppmoderne å sette statiske bilder inn i bevegelsesmodeller. Vil forskere noen gang lykkes med å se maskiner som ribosomet, ATP-syntase og bakterieflagellen i sanntid, som filmer, med superoppløsning? Husk, aldri si aldri, fordi mennesker er flinke. Vi kan allerede ha stor interesse i, og glede oss over, det "oppløsningsrevolusjonen" har brakt oss.
...
Grand Central Station og videre: Molekylære maskiner visualisert i 3D
David Coppedge, 29. sept. 2022 Oversatt herfra
Bilde 6. Grand Central Station (London)
 Kryo-elektronmikroskopi lar cellebiologer se ikke-reduserbare komplekse molekylære maskiner i all sin tredimensjonale prakt. Vi er privilegerte i vår tid, til å se ting som tidligere mikroskopister ikke kunne ha drømt om var mulig, takket være avbildningsteknologier med superoppløsning.
Kryo-elektronmikroskopi lar cellebiologer se ikke-reduserbare komplekse molekylære maskiner i all sin tredimensjonale prakt. Vi er privilegerte i vår tid, til å se ting som tidligere mikroskopister ikke kunne ha drømt om var mulig, takket være avbildningsteknologier med superoppløsning.
Cilia-oppdatering
Molekylærbiologer ved Universitetet i Basel skrøt denne måneden av å oppdage en "miniatyrtogstasjon" ved bunnen av ciliumet. Evolution News-lesere vet kanskje at biolog Michael Behe snakket om disse togene for mange år siden i sine to første bøker, basert på det som da var kjent om hvordan flimmerhårene er konstruert. Noen få forsøk på å animere flimmerhår med tidligere cryo-EM-visninger, som dette på XVIVO -lenke, avslører delene av flimmerhår og flageller og hvordan de fungerer når de først er konstruert. Men det er ingenting som å avbilde dem med ekte mikroskoper med nesten atomær oppløsning for å se hvordan de er bygget. Bildene av togstasjoner virker passende.
-Cilia er godt forankret til cellen ved deres basis. "Her er startstasjonen for transport av flimmerhår," forklarer Hugo van den Hoek, førsteforfatter av studien. "Togene er satt sammen her, opplastet og plassert på skinnene." Det er totalt ni forskjellige skinner inne i flimmerhår, kalt mikrotubuli. Hver av dem består av to spor, ett for utgående tog og ett for inngående. Togene transporterer proteiner som signalmolekyler og byggematerialer til spissen av flimmerhårene. På deres destinasjonsstasjon blir toget losset og demontert. [Understreking lagt til.]
En kombinasjon av kryo-EM-tomografi og fluorescensmikroskopi tillot forskerteamet å observere den store sentralstasjonen.
– Fra fluorescensmikroskopi kjenner vi også den nøyaktige rutetiden til togene. Togene forlater startstasjonen innen ni sekunder, og så starter hele togmonteringsprosessen igjen.»
En ekstra metode kalt ekspansjonsmikroskopi tillot kartlegging av alle delene på tomografidataene.
"Denne kraftige kombinasjonen av teknologier har gjort det mulig for oss å rekonstruere den første molekylære modellen av ciliærbasen og observere hvordan den regulerer sammensetningen og inngangen til disse store proteintogene," forklarer Paul Guichard.
Bilde 7. Funksjonelt samsvar mellom deler
 Noen som ser fremsyn her? Funksjonell informasjon?
Noen som ser fremsyn her? Funksjonell informasjon?
Artikkelen i Science av Van den Hoek et al., "In situ-arkitektur av den ciliære basen avslører den trinnvise sammenstillingen av intraflagellar transporttog," -lenke, fortsetter med togmetaforen over 90 ganger.
Som illustrerer Behes påstand tilbake i 1996 om at vitenskapelige artikler aldri forklarer hvordan disse maskinene kunne lages ved en darwinistisk prosess, er denne artikkelen igjen taus om evolusjon. Den bemerker bare at flimmerhår og flageller er "evolusjonært konserverte eukaryote organeller" som antyder at de allerede virket, og ikke har utviklet seg nevneverdig siden. De nevner også alvorlige sykdommer som skyldes feilmontering av disse utsøkte ATP-drevne bevegelige maskinene. Dette taler også om umuligheten av tilfeldighetsdannelse.
Leserne kan glede seg over de detaljerte bildene som kommer fra disse kraftige nye bildeteknologiene.
"Funnene deres belyser hvordan intraflagellære transporttog samles før de går inn i flimmerhår og demonstrerer muligheten for å visualisere dynamiske hendelser med molekylær 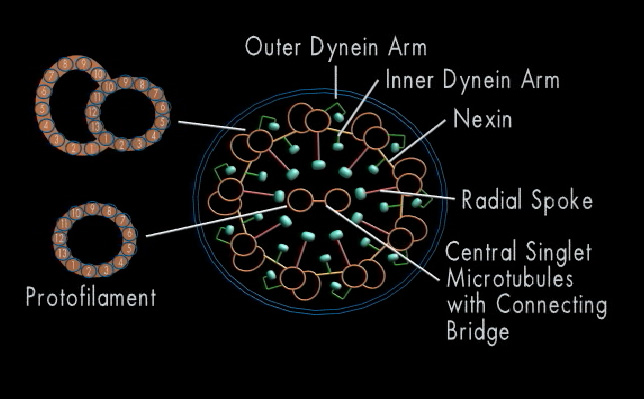 oppløsning inne i innfødte celler."
oppløsning inne i innfødte celler."
Bilde 8. Tverrsnitt gjennom cilia
Cilia ble også fremhevet nylig i nyheter fra Washington University -lenke. Ingeniører der vil gjerne forstå hvordan flimmerhår initierer sine velkjente beat-bevegelser for å få ideer for å behandle ciliopatier og kanskje etterligne flimmerhår i konstruerte maskiner for medikamentlevering eller kjemisk sensing.
"Cilia er små, hårlignende strukturer på celler i hele kroppen vår som slår rytmisk for å tjene en rekke funksjoner når de fungerer som de skal, inkludert sirkulering av cerebrospinalvæske i hjernen og transport av egg i egglederne.
Defekte flimmerhår kan føre til lidelser inkludert situs inversus - en tilstand der en persons organer utvikler seg på motsatt side av hvor de vanligvis er."
Arbeidet deres ble publisert i Journal of the Royal Society Interface -lenke.
 Kir2.1: En elegant Ione kanal
Kir2.1: En elegant Ione kanal
Kryo-elektronmikroskopi avduket en annen fantastisk molekylær maskin for øynene til forskere ved Sorbonne. Det kalles Kir2.1, en del av en familie av kaliumkanaler som skaper spenningen som brukes av nevroner. Her er hva Kir2.1 gjør for oss:
-Innover-likeretter kalium (Kir) kanaler er en gruppe av integrerte membran-proteiner som selektivt kontrollerer permeasjonen av K+ (kalium) ioner over cellemembraner. De er spesielle ved at kanalene leder K+ioner lettere i retning innover (inn i cellen) enn i retning utover (ut av cellen). Den lille utadgående K+-strømmen gjennom Kir-kanalene kontrollerer hvilemembranpotensialet og membranens eksitabilitet, regulerer hjerte- og nevronale elektriske aktiviteter, kobler insulinsekresjon til blodsukkernivået og opprettholder elektrolyttbalansen.
Bilde 9. Ionekanaler er 'fininnstilte'
Kildeartikkelen til Fernandes et al. ble publisert som åpen tilgang i Science Advances -lenke, slik at leserne kan se de vakre bildene av denne kanalen med dens firedelte struktur og selektivitetsfilter. De hevder at det er den "første strukturen" publisert av Kir2.1. Gjennomsnittlig oppløsning er på 4,3 Ångstrøm, med noen deler på 3,7 Ångstrøm. Med tanke på at bredden på et hydrogenatom er omtrent 1 Ångstrøm, er det utrolig.
-Dette er første gang hele den menneskelige Kir2.1-kanalen har blitt fremvist med høy oppløsning; det er også den første cryo-EM-strukturen til en Kir2-kanal.
Hvordan fungerer kanalen som en likeretter, og skaper en spenning mellom indre og ytre membraner? Og hvordan vet de når de skal handle?
"Den innoverrettede mekanismen er et resultat av en blokkering på den cytoplasmatiske siden av kanalene av endogene polyaminer og Mg2+ som plugger kanalporen ved depolariserte potensialer, noe som resulterer i reduserte utadgående strømmer. Blokkererene fjernes deretter fra poren når K+-ionene strømmer inn i cellen ved hyperpolariserte potensialer. Denne spenningsavhengige blokken resulterer i effektiv ledning av strøm bare i retning innover. I tillegg til å korrigere innover, reagerer Kir-kanaler på en rekke intracellulære budbringere som direkte kontrollerer kanalporten, inkludert fosfoinositider (PIP), G-proteiner (Kir3-kanaler), adenosin 5′-trifosfat (Kir6-kanaler) og endringer i pH (Kir1-kanaler). Kir-familien er kodet av 16 gener (KCNJ1 til KCNJ18) og klassifisert i syv underfamilier (Kir1 til Kir7)."
Kir2.1-kanalen sitter ikke bare der i membranen og velger kaliumioner; den beveger seg! Den bøyer seg og bøyer seg under drift. Lesere kan laste ned seks filmer av maskinen som gjennomgår sine presise konformasjonsendringer.
Når kanalen bøyer seg, dannes og brytes spesifikke kontakter mellom aminosyrer for å tillate nøyaktig passasje av kaliumioner gjennom selektivitetsfilteret og tre andre innsnevringspunkter, en kalt G-løkken hvor den endelige kaliumporten antas å forekomme. Innsnevringene, så smale som 1/5 av en Ångstrøm, fungerer som porter som blokkerer alt, til det riktige kaliumionet er autentisert. Her er en smakebit på presisjonen:
-Avslutningsvis beskriver vår humane Kir2.1-kanal cryo-EM-struktur et godt koblet interaksjonsnettverk mellom PIP2-bindingsstedrestene, R218 og K219, og G-loop-regionen (E303) via restene R312 og H221. Våre data tyder på at konformasjonsendringene som kreves for G-løkkeåpningen mest sannsynlig kontrolleres av PIP2-binding. Erstatningen av R312 med histidin fører til fullstendig tap av interaksjonsnettverket beskrevet ovenfor. Derfor synes interaksjons-nettverkets integritet mellom underenheter nødvendig for riktig allosterisk overføring av signalet mellom R312 og G-løkken til den tilstøtende underenheten ved PIP2-binding, som muligens tillater frigjøring av innsnevringspunktet på G-løkken. Vi kan da anta en PIP2-avhengig G-loop-portmekanisme, som består av følgende: PIP2-binding utløser lokale konformasjonsendringer i posisjonen til side- og hovedkjedene til R218 og K219, som på grunn av den strukturelle nærheten fører til betydelig endringer i posisjonen til H221, og forskyver den lateralt mot det intracellulære mediet. Denne bevegelsen vil i sin tur føre til at E303 og R312 i den tilstøtende kjeden beveger seg i samme retning, noe som får G-løkken til å åpne seg.
Uten å ville overdrive den tekniske sjargongen, så blir designet kun tydelig i detaljene. Nok en gang vil leserne se forgjeves etter omtale av hvordan denne kanalen dukket opp eller utviklet seg.
Overrsettelse og bilder ved Asbjørn E. Lund
 Aldri si aldri, fordi mennesker er flinke. Fysikklærere pleide å si at mennesker aldri vil kunne se atomer gjennom noe mikroskop på grunn av en grunnleggende barriere for oppløsning kalt diffraksjonsgrensen. Men i likhet med fireminuttersmila og lydmuren, ble denne rekorden laget for å slås. I dag gjør optiske ingeniører det. Individuelle atomer kommer i fokus!
Aldri si aldri, fordi mennesker er flinke. Fysikklærere pleide å si at mennesker aldri vil kunne se atomer gjennom noe mikroskop på grunn av en grunnleggende barriere for oppløsning kalt diffraksjonsgrensen. Men i likhet med fireminuttersmila og lydmuren, ble denne rekorden laget for å slås. I dag gjør optiske ingeniører det. Individuelle atomer kommer i fokus! Kryo-elektronmikroskopi
Kryo-elektronmikroskopi Multifocus 3-D Imaging tok et sprang med en ny teknikk som Phys.org kaller en "enkel måte å fange høykvalitets 3D-bilder av levende celler og organismer." Et team ledet av Sheng Xiao fra Boston University brukte et z-splitterprisme for å dele lysstråler fra prøven i "flere bilder, hver fokusert til en annen dybde i prøven, i en enkelt kameraramme." I stedet for et flatt bilde i ett fokalplan, gir denne teknikken 3D-bilder fra standard optiske mikroskoper. "Vi brukte et z-splitterprisme som kan settes helt sammen fra hyllekomponenter og som enkelt kan brukes på en rekke avbildningsmodaliteter som fluorescens, fasekontrast eller mørkfeltsavbildning," sa Xiao. Det kan "bare legges til de fleste eksisterende systemer og er enkelt å replikere, noe som gjør det tilgjengelig for andre forskere." Teknikken deres er beskrevet i tidsskriftet Optica.
Multifocus 3-D Imaging tok et sprang med en ny teknikk som Phys.org kaller en "enkel måte å fange høykvalitets 3D-bilder av levende celler og organismer." Et team ledet av Sheng Xiao fra Boston University brukte et z-splitterprisme for å dele lysstråler fra prøven i "flere bilder, hver fokusert til en annen dybde i prøven, i en enkelt kameraramme." I stedet for et flatt bilde i ett fokalplan, gir denne teknikken 3D-bilder fra standard optiske mikroskoper. "Vi brukte et z-splitterprisme som kan settes helt sammen fra hyllekomponenter og som enkelt kan brukes på en rekke avbildningsmodaliteter som fluorescens, fasekontrast eller mørkfeltsavbildning," sa Xiao. Det kan "bare legges til de fleste eksisterende systemer og er enkelt å replikere, noe som gjør det tilgjengelig for andre forskere." Teknikken deres er beskrevet i tidsskriftet Optica.
 I en kommentar til denne modellen i Nature Structural & Molecular Biology, beskrev Keiichi Namba den som et "to-tannhjul"-arrangement. Dette kan forklare hvordan rotoren kan bytte retning i en kvart omdreining, som Jed Macosco har sagt -hefra. Namba sier,
I en kommentar til denne modellen i Nature Structural & Molecular Biology, beskrev Keiichi Namba den som et "to-tannhjul"-arrangement. Dette kan forklare hvordan rotoren kan bytte retning i en kvart omdreining, som Jed Macosco har sagt -hefra. Namba sier, Kryo-elektronmikroskopi lar cellebiologer se ikke-reduserbare komplekse molekylære maskiner i all sin tredimensjonale prakt. Vi er privilegerte i vår tid, til å se ting som tidligere mikroskopister ikke kunne ha drømt om var mulig, takket være avbildningsteknologier med superoppløsning.
Kryo-elektronmikroskopi lar cellebiologer se ikke-reduserbare komplekse molekylære maskiner i all sin tredimensjonale prakt. Vi er privilegerte i vår tid, til å se ting som tidligere mikroskopister ikke kunne ha drømt om var mulig, takket være avbildningsteknologier med superoppløsning. Noen som ser fremsyn her? Funksjonell informasjon?
Noen som ser fremsyn her? Funksjonell informasjon? oppløsning inne i innfødte celler."
oppløsning inne i innfødte celler." Kir2.1: En elegant Ione kanal
Kir2.1: En elegant Ione kanal